能够不破坏蛋白质活性的新型拉曼光谱分析技术

生物医学研究瞄准许多复杂性,以解开隐藏的路径、结构细微差别和互动范式,这些范式对于理解和解决无数医学难题至关重要。这一科学旅程中的一个工具是拉曼光谱学(Raman spectroscopy)——一种非破坏性化学分析技术,提供有关化学结构、相位和多态性、结晶性和分子相互作用的重要信息。然而,五十多年来,由于固有的挑战,拉曼光谱在生物医学领域的潜在适用性受到了严重限制。最值得注意的是,传统拉曼光谱中使用的高能光在光学测量过程中几乎破坏了活蛋白质,阻碍了结果的重现性和可靠性。

最近,美国德克萨斯农工大学量子科学与工程研究所和德克萨斯农工工程实验站的研究人员研发了一种解决这一长期障碍的新技术。被称为热稳定性拉曼相互作用分析( Thermostable Raman Interaction Profiling, TRIP),这种创新方法通过在生理相关条件下实现蛋白质与配体相互作用(protein-to-ligand)的低浓度和低剂量筛选来重塑生物医学研究和临床应用的轮廓,同时确保无标签、高度可重复的拉曼光谱测量。
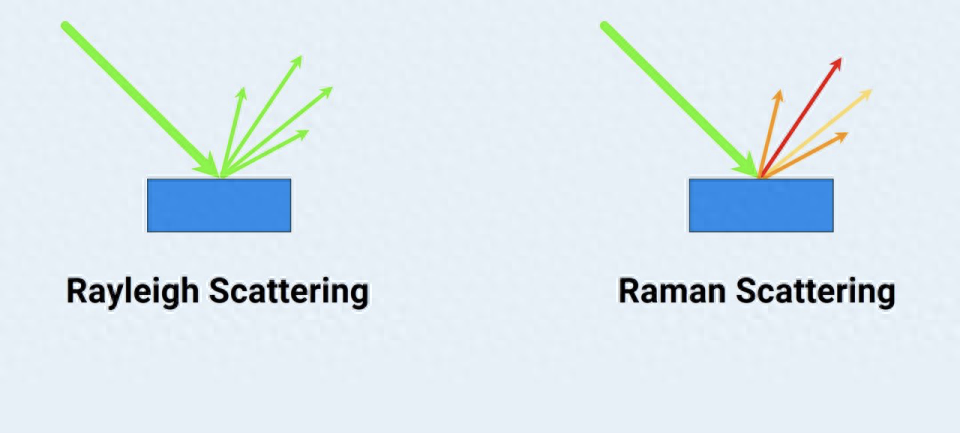
从历史上看,拉曼光谱的工作机制取决于样品中光和化学键之间的相互作用。当单色光指向样品时,大多数散射光会保持入射光的频率,称为瑞利散射。然而,一小部分光会在被改变的频率上散射,这种现象被确定为拉曼散射。这种拉曼散射光频率改变,即入射光和散射光之间的能量差异,泄露了有关样品中分子振动模式的明确信息,为识别和分析提供了分子“指纹”。
TRIP方法的关键是提高灵敏度并最大限度地减少与传统拉曼光谱相关的损害。它采用热稳定方法,在整个分析过程中保持蛋白质的结构完整性,即使在涉及低浓度蛋白质的情况下也是如此。
TRIP方法还扩展到无标签分析领域(label-free analysis),当结合其更高的灵敏度和稳定性时,甚至可以从更小和低浓度的样本中进行详细和可靠的数据采集。
从生物医学的角度来看,TRIP方法非常有意义。蛋白质-配体相互作用,类似于钥匙和锁的机制,开启了各种生化过程,如信号转导、免疫反应和基因调控。TRIP实时检测这些相互作用的能力可能会使药物和疫苗测试的时间缩短。此外,其适用性扩展到临床领域,提供了将用于病毒检测的长时间测试程序(如用于病毒检测的测试程序)转化为快速、当天结果的可能性。
TRIP技术为蛋白质和药物之间的高通量药物筛选和实时结合测量铺平了道路,为药物开发领域的 研究人员和制药企业提供了不可或缺的工具。它促进了一个可以观察、分析和理解相互作用的分析工具,提供不仅实时而且与现实世界相关的数据。

尽管目前取得了突破,但研究团队继续探索TRIP方法可能发挥作用的不同前景。随后的研究将试图破译蛋白质的化学成分,利用TRIP技术来探索与DNA和其他生物分子相关的分析,尝试在不需要测序的情况下进行分析的可能性。
